Werkboek: kinderendocrinologie
Pasgeborene van moeder met schildklieraandoening – Beleid
Samenvatting
Schildklierhormoon (SKH) is onmisbaar voor normale embryonale en foetale ontwikkeling. Gedurende de gehele zwangerschap voorziet de moeder embryo/foetus via de placenta van SKH, later in de zwangerschap levert de foetale schildklier een steeds grotere bijdrage. Maternale schildklierdisfunctie, resulterend in lagere of hogere dan normale (maternale) SKH concentraties en daarmee lager of hogere trans-placentaire overdracht naar embryo/foetus, kan de normale vroege ontwikkeling verstoren.
Maternale schildklierdisfunctie wordt meestal veroorzaakt door auto-immuun hypo- of hyperthyreoïdie, d.w.z. de ziekte van Hashimoto en Graves. Auto-immuun hyperthyreoïdie wordt veroorzaakt door stimulerende TSH receptorantilichamen (TSHR Ab). Bij patiënten met auto-immuun hypothyreoïdie kunnen blokkerende TSHR Ab voorkomen. Maternale TSHR Ab passeren de placenta vanaf halverwege de zwangerschap en kunnen foetale en neonatale hyper- of hypothyreoïdie veroorzaken. Schildklier-remmende medicatie, door de zwangere vrouw gebruikt voor behandeling van auto-immuun hyperthyreoïdie, passeert eveneens de placenta en kan foetale en voorbijgaande neonatale hypothyreoïdie veroorzaken.
Vanwege aanzienlijke morbiditeit en zelfs fatale afloop worden foetale en neonatale hyperthyreoïdie als ernstige aandoeningen beschouwd. Dit hoofdstuk biedt een praktische benadering van de klinische behandeling van pasgeborenen van moeders met schildklierdisfunctie.
Inleiding en definitie
Vanaf het begin van de zwangerschap hebben embryo en foetus schildklierhormoon (SKH) nodig voor veel ontwikkelingsprocessen. Optimale SKH concentraties worden bereikt door een intrigerende samenwerking tussen de moeder en het/de zich ontwikkelende embryo/foetus.
Er is aangetoond dat maternaal SKH tijdens de zwangerschap de placenta passeert. Bovendien produceert de embryonale schildklier kleine hoeveelheden SKH vanaf een zwangerschapsduur van ongeveer 10 tot 11 weken. Echter, pas nadat de foetale hypothalamus-hypofyse-schildklier (HHS)-as functioneel wordt, enkele weken later bij een zwangerschap van ongeveer 20 weken, neemt de foetale SKH-productie toe. Tot dat moment zijn embryo en foetus afhankelijk van kleine hoeveelheden maternaal SKH.
Er is bewijs dat zowel lage als hoge maternale plasma SKH concentraties vroeg in de zwangerschap, waarschijnlijk resulterend in abnormale embryonale/vroege foetale TH-spiegels, geassocieerd zijn met een verminderde neurocognitieve functie bij nakomelingen. Bovendien kunnen abnormale SKH-concentraties in foetaal plasma tijdens de zwangerschap het postnatale functioneren van HHS-as veranderen, niet alleen in de neonatale periode, maar ook lang daarna.
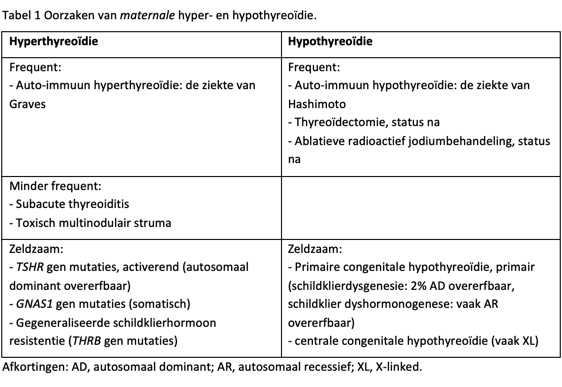
Lage of hoge maternale plasma SKH concentraties zijn meestal het gevolg van maternale schildklierdisfunctie, resulterend in lager of hoger dan normaal trans-placentair SKH-transport en daarmee lagere of hogere dan normale embryonale/vroege foetale SKH-concentraties. Maternale disfunctie kan zowel hypo- als hyperthyreoïdie zijn, waarbij verworven ziekte – voornamelijk auto-immuniteit van de schildklier, maar ook (status na) thyreoïdectomie of 131I behandeling – veel vaker de oorzaak is dan aangeboren ziekte.
Naast maternale schildklierziekte gerelateerde abnormale maternale SKH-concentraties die van invloed zijn op de embryonale/vroege foetale SKH-concentraties, kan de (vroege) foetale en neonatale schildklierfunctie worden verstoord door trans-placentair van de moeder verkregen stimulerende of blokkerende TSH-receptorantilichamen (TSHR Ab), en door schildklier-remmende medicatie die door de moeder worden gebruikt voor de behandeling van hyperthyreoïdie. Stimulerende TSHR Ab kunnen foetale en voorbijgaande neonatale hyperthyreoïdie veroorzaken.
Epidemiologie en pathofysiologie
Maternale schildklierdisfunctie wordt voornamelijk veroorzaakt door auto-immuunziektes van de schildklier. De prevalenties van auto-immuun hypothyreoïdie (ziekte van Hashimoto) en auto-immuun hyperthyreoïdie (ziekte van Graves) en bij vrouwen is respectievelijk ongeveer 0,3% en 0,5%. Bovendien heeft ten minste 2-3% van de gezonde niet-zwangere vrouwen in de vruchtbare leeftijd een verhoogd TSH, en 30-60% van de zwangere vrouwen met een verhoogd TSH heeft detecteerbare auto-antilichamen van de schildklier.
Maternale auto-immuun hypothyreodie (de ziekte van Hashimoto)
Bij de ziekte van Hashimoto – gekenmerkt door de aanwezigheid van anti-thyreoperoxidase antistoffen (TPO Ab) – komt in 10-20% van de gevallen blokkerende TSHR Ab voor die, als ze de foetale circulatie bereiken, foetale en voorbijgaande neonatale hypothyreoïdie kunnen veroorzaken. De incidentie van voorbijgaande neonatale hypothyreoïdie ligt rond 1:180,000.
Bij veel zwangere vrouwen met auto-immuun hypothyreoïdie is de diagnose reeds voor de zwangerschap gesteld en wordt behandeld met LT4. Als LT4 correct wordt gedoseerd, dan is er geen probleem voor het embryo/de foetus.
Maternale TPO Ab kunnen de placenta passeren, maar die hebben geen invloed op de foetale of neonatale schildklierfunctie.
Maternale blokkerende TSHR Ab passeren ook de placenta en kunnen (voorbijgaande) neonatale hypothyreoïdie veroorzaken. Omdat de neonatale CH-screening deze vorm van voorbijgaande primaire CH detecteert, is eerder onderzoek bij een pasgeborene van een moeder met hypothyreoïdie o.b.v. de ziekte van Hashimoto niet nodig. Daarnaast is dit ook nog eens een zeer zeldzaam probleem.
Maternale auto-immuun hyperthyreoïdie (de ziekte van Graves)
De ziekte van Graves wordt gekenmerkt door de aanwezigheid van stimulerende TSHR Ab; als die trans-placentair de foetus bereiken kunnen die foetale en voorbijgaande neonatale hyperthyreoïdie veroorzaken. Voorbijgaande neonatale hyperthyreoïdie treedt op in minder dan 5% van pasgeborenen van moeders met (status na) de ziekte van Graves, de incidentie is daarmee ongeveer 1:50,000.
Drie scenario’s kunnen worden onderscheiden:
Scenario 1
De zwangere vrouw bij wie in het verleden auto-immuun hyperthyreoïdie is vastgesteld en die een definitieve behandeling heeft gekregen.
Na definitieve behandeling van auto-immuun hyperthyreoïdie kan de productie van TSHR Ab nog lang aanhouden, de kans daarop is groter bij vrouwen die behandeling met radioactief jodium hebben ondergaan dan bij vrouwen die een thyreoïdectomie hebben ondergaan. Auto-immuniteit wordt echter tijdens de zwangerschap meestal onderdrukt, wat leidt tot afnemende TSHR Ab-concentraties en daarmee tot een lagere trans-placentaire overdracht. Als TSHR Ab aanwezig zijn en blijven tot halverwege de zwangerschap en de placenta passeren, kunnen ze foetale hyperthyreoïdie veroorzaken. Als TSHR Ab aanwezig blijven tot het einde van de zwangerschap, kunnen ze (voorbijgaande) neonatale hyperthyreoïdie veroorzaken. In het beloop van auto-immuun hyperthyreoïdie kunnen TSHR Ab van “karakter” veranderen, en i.p.v. stimuleren alleen maar binden, of binden en blokkeren. Dat is waarschijnlijk de verklaring dat bij circulerende TSHR Ab niet altijd foetale of neonatale hyperthyreoïdie ontstaat.
Scenario 2
De zwangere vrouw bij wie meer recent de diagnose auto-immuun hyperthyreoïdie is gesteld en die sindsdien wordt behandeld met schildklier-remmende medicatie plus of min LT4.
Net als in scenario één kunnen TSHR Ab foetale hyperthyreoïdie veroorzaken vanaf halverwege de zwangerschap. In dit scenario vormt de schildklier-remmende medicatie van de moeder een extra risico.
Als te hoog gedoseerd, kan het de foetale SKH-productie schaden en foetaal struma veroorzaken. Als tegelijkertijd de SKH concentraties van de moeder lager zijn dan wenselijk, lopen groei en ontwikkeling van de foetus gevaar. Bij te lage dosering kunnen maternale SKH concentraties en maternofoetaal SKH-transport hoger zijn dan normaal, ook dan kunnen groei en ontwikkeling van de foetus in gevaar komen.
Scenario 3
Centrale CH bij pasgeborenen van moeders met onvoldoende behandelde of (nog) niet gediagnosticeerde auto-immuun hyperthyreoïdie.
Af en toe leidt maternale hyperthyreoïdie t.g.v. de ziekte van Graves tijdens de zwangerschap tot centrale congenitale hypothyreodie (CH) bij de pasgeborene. De geschatte incidentie hiervan is 1:35,000. Vaak gaat het hierbij om zwangeren met nog niet gediagnostiseerde of matig behandelde hyperthyreoïdie. De centrale CH kan van voorbijgaande aard zijn, maar kan ook overgaan in primaire CH (door onvoldoende pre- en postnatale groei en ontwikkeling van de schildklier).
De oorzaak van de centrale CH is waarschijnlijk langdurige onderdrukking van de hypofysaire TSH productie van de foetus door maternaal SKH of door TSHR Ab gemedieerde foetale SKH overproductie.De duur van de voorbijgaande neonatale hypo- en hyperthyreoïdie is meestal niet langer dan 3 maanden (4-5 x de serum halfwaardetijd van de maternale TSHR Ab).
Behandeling
Behandeling van (maternale) hypothyreoïdie bestaat uit dagelijkse toediening van SKH (levothyroxine, LT4).
Auto-immuun hyperthyreoïdie wordt gewoonlijk “medisch” behandeld met een schildklier-remmend medicament (thiamazol [TMZ] of propylthiouracil [PTU]) plus of min LT4 volgens de methode “blokkeren en vervangen” of “titratie”. Net als SKH kunnen schildklier-remmend medicijnen de placenta passeren tijdens de zwangerschap. Als (te) hoog gedoseerd kan door de zwangere gebruikte schildklier-remmende medicatie foetale hypothyreoïdie en struma veroorzaken. Als de medicatie t/m het einde van de zwangerschap wordt gebruikt, kan dit resulteren in (iatrogene) primaire CH bij de pasgeborene. Met het doorknippen van de navelstreng stopt echter de blootstelling van de pasgeborene aan de schildklier-remmende medicatie. Doordat halfwaardetijd van schildklier-remmende medicatie kort is, duurt dit meestal niet langer dan 4-7 dagen.
De oorzaken van maternale hyper- en hypothyreoïdie – inclusief schildklier auto-immuniteit – zijn te vinden in Tabel 1.
Drempel voor evaluatie
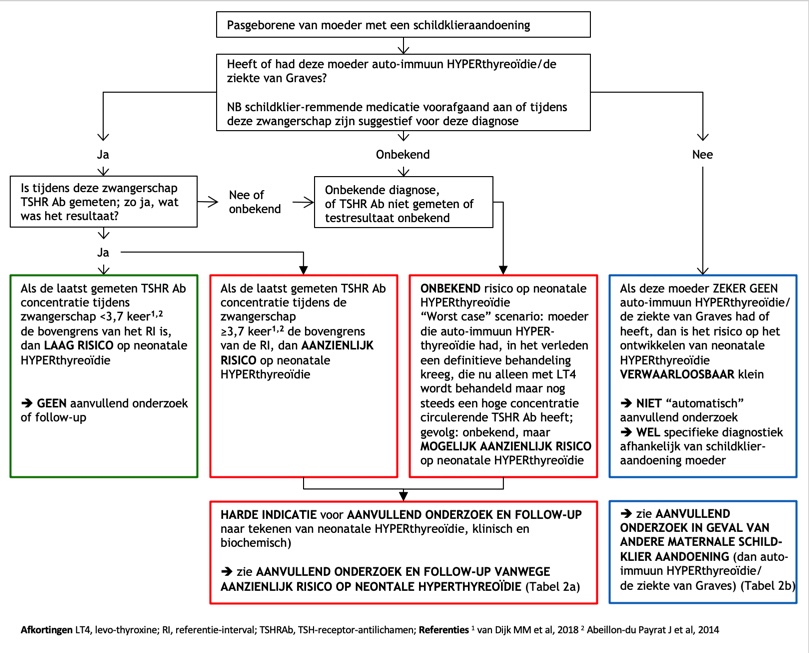
Zie flowchart.
De eerste stap bij de beoordeling van een pasgeborene van een moeder met een schildklieraandoening, is het achterhalen van de diagnose van de moeder.
Als de moeder auto-immuun hyperthyreoïdie/de ziekte van Graves had of heeft, dienen de medicatie van de moeder en de laatst gemeten TSHR Ab-concentratie (bij voorkeur laat in het derde trimester) te worden achterhaald.
Als de laatste maternale TSHR Ab-concentratie <3,7 keer de bovengrens van het referentie-interval was, dan is de kans dat de neonaat hyperthyreoïdie heeft of kan krijgen zo klein dat aanvullend onderzoek of follow-up niet geïndiceerd is (groen omkaderde box).
Als de laatste maternale TSHR Ab-concentratie ≥3,7 maal de bovengrens van het referentie-interval was, of als dit resultaat niet beschikbaar is dan wel de diagnose van moeder onbekend is (rood omkaderde boxen), moet er navelstreng (NS) bloed worden afgenomen om TSHR Ab, TSH en FT4 te meten, en moet de pasgeborene worden onderzocht op tekenen van hyperthyreoïdie (prikkelbaarheid, wijd open ogen, transpiratie/warme en vochtige huid, hyperthermie, tachycardie, tachy- en dyspneu, struma, slecht drinken en onvoldoende gewichtstoename).
Als in navelstrengbloed of bloed afgenomen tijdens de eerste drie levensdagen de TSHR Ab-concentratie <4,0 keer de bovengrens van het referentie-interval is, dan is de kans dat de neonaat hyperthyreoïdie heeft of ontwikkelt zo klein dat verder aanvullend onderzoek en follow-up niet geïndiceerd is.
Bij een neonatale TSHR Ab concentratie ≥4,0 keer de bovengrens van het referentie-interval is wel aanvullend onderzoek en follow-up geïndiceerd, zeker als er (ook) tekenen van hyperthyreoïdie zijn.
Als het zeker is dat het GEEN auto-immuun hyperthyreoïdie/de ziekte van Graves was (bovenste blauw omkaderde box), dan is routinematig aanvullend onderzoek of follow-up niet nodig.
Bij pasgeborenen van moeders met auto-immuun hypothyreoïdie/de ziekte van Hashimoto is door TSHR Ab geïnduceerde voorbijgaande primaire CH een zeldzame aandoening. Indien aanwezig, kan het worden opgespoord door neonatale CH-screening. Hetzelfde geldt voor (ook zeldzame) erfelijke of familiair voorkomende primaire CH (bij de moeder, en misschien bij de pasgeborene). Als de moeder draagster is van een mutatie in een van de genen die centrale CH veroorzaken, is het raadzaam om de pasgeborene op deze diagnose te testen, vooral in het geval van X-gebonden vormen bij jongens (door meting van serum FT4 en TSH; onderste blauw omkaderde box).
Differentiaaldiagnose
Zie tabel 1
Evaluatie
Zie Flowchart en Tabel 2a en 2b.
Referenties/links
Léger J et al. Fetal and Neonatal Thyroid Dysfunction. J Clin Endocrinol Metab. 2022 Feb 17;107(3):836-846. doi: 10.1210/clinem/dgab747.
van Trotsenburg ASP. Management of neonates born to mothers with thyroid dysfunction, and points for attention during pregnancy. Best Pract Res Clin Endocrinol Metab. 2020 Jul;34(4):101437. doi: 10.1016/j.beem.2020.101437. Free article: https://pubmed.ncbi.nlm.nih.gov/32651060/
van der Kaay DC et al. Wasserman JD, Palmert MR. Management of Neonates Born to Mothers With Graves’ Disease. Pediatrics. 2016 Apr;137(4):e20151878. doi: 10.1542/peds.2015-1878. Epub 2016 Mar 15.
Beslisboom
Tabellen
Tabel 2a Aanvullend onderzoek en follow-up vanwege aanzienlijk risico op neonatale hyperthyreoïdie.

Tabel 2b Aanvullend onderzoek in geval van andere maternale schildklieraandoening (dan auto-immuun hyperthyreoïdie/de ziekte van graves).

Afkortingen
B&R, block and replace; FT4, vrij thyroxine; LT4, levothyroxine; RI, referentie-interval; TSH, schildklier stimulerend hormoon; TSHR Ab, TSH-receptor-antilichamen
Referenties
1 Abeillon-du Payrat J et al, 2014
2 Kiefer FW et al, 2016
3 Akangire G et al, 2017
4 Joshi K et al, 2018
Lijst met afkortingen
CH, congenitale hypothyreodie; FT4, free thyroxine; HHS, hypothalamus-hypofyse-schildklier; LT4, levothyroxine; TMZ, thiamazol; PTU, propylthiouracil; SKH, schildklierhormoon; TPO Ab, anti-thyreoperoxidase antistoffen; TSH, thyroid stimulating hormone; TSHR Ab, TSH receptorantilichamen.
Trefwoorden
1. Ziekte van Graves
2. Ziekte van Hashimoto
3. TSH receptor antilichamen
4. Neonatale hyperthyreoïdie
5. Centrale congenitale hypothyreoïdie
© 2022. Alle rechten voorbehouden